| 会议详情 |
|

推荐会议:CMIS 2026第七届中国医药数智峰会
发票类型:增值税普通发票 增值税专用发票
三生国健药业(上海)股份有限公司
PharmaCon 2017第三届中国国际化学药大会再次登台
国内唯一囊括化学药研发、生产、质量管理 的深度论坛
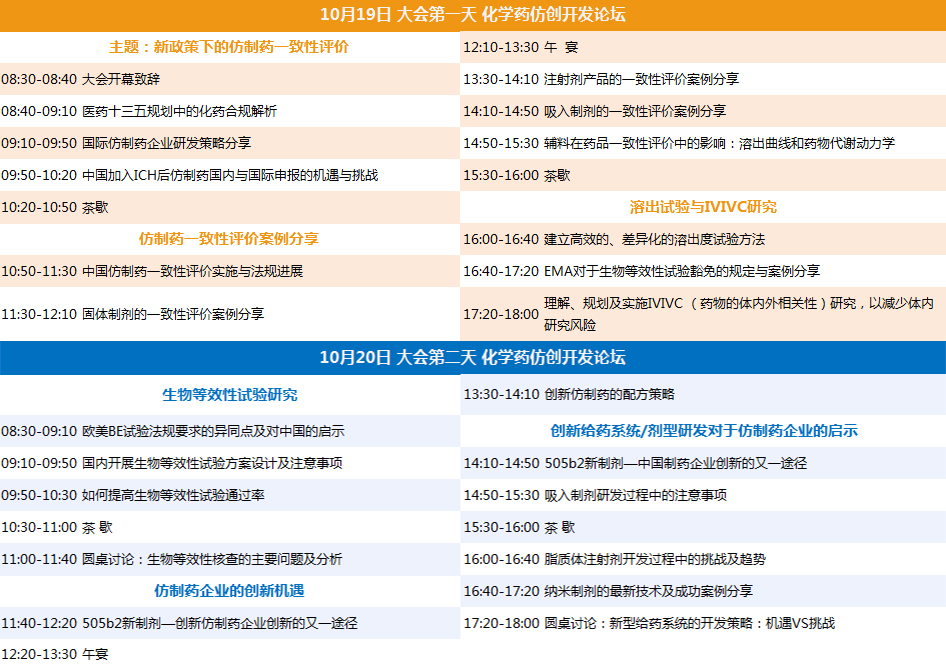
2017年10月19-20日 上海
近年来药品相关的新法规及政策频出,仿制药一致性评价、新药品上市许可人制度、新药品注册分类办法、药用包材与药用辅料关联审评、新GMP飞检、计算机化系统验证等重磅新政对医药行业产生了重大影响。
在此背景下,PharmaCon 2017第三届中国国际化学药大会作为行业内的年度品牌峰会,将汇聚50余位药品监管机构官员,行业意见领袖以及领先化药企业代表,从药品研发与生产质量管理两个板块出发,就行业最为关注的化学药品注册法规政策、仿创开发策略与技术、新GMP合规环境下的生产质量管理及新型绿色环保与低成本生产工艺等热点问题进行剖析,并提供高实践性的解决方法和思路。
PharmaCon 2017第三届中国国际化学药大会由中国化学药制药工业协会和上海商图信息(BMAP)联合主办。大会由两个平行论坛组成,即化学药研发论坛和医药生产与质量管理论坛,预计将有500余人参会。立新在途,落地在质,共同探索化学药研发与生产的进阶之旅。
化学药仿创开发论坛 (分论坛一)
论坛独特亮点:
交流不同剂型在仿制药一致性评价中的全程案例研究与经验
讨论溶出实验、IVIVC、生物等效性试验方案设计,提高生物等效性试验通过率
学习领先企业在2类新药、505b2新药申请的法规与开发的最新动态
探索仿创药物开发战略,差异化布局创新给药途径及制剂,突破化药创新
追踪国内外生物等效性实验等仿制药一致性评价的最新政策、法规与指南动态
生产与质量管理论坛 (分论坛二)
论坛独特亮点:
追踪最新药品生产中MAH制度、计算机系统验证、数据管理的法规动态
学习领先药厂在计算机化系统验证以及数据可靠性在生产中的最佳应用
探索领先企业在中外GMP体系下的质量管理、过程控制与清洁验证、风险控制的优秀实践
解析生产工艺放大过程中的难点与应对思路 ,确保产品最终质量
分享如何在实现GMP合规下,进行智能、绿色、低成本生产
400+参会人员
来自产学研医资政的,专家共享共襄盛会
50+演讲嘉宾
多方专业思想碰撞,跨界交锋,干货满载
200+企业单位
国内外领先企业,高效对接实现跨越
20+黄金小时
时间、商务价值并存,启发激发受益匪浅
往届精彩回顾:
本次活动已圆满举办两届,2016年第二届中国国际化学药开发高峰论坛中20余位国内药品监管机构官员、行业意见领袖、国内领先化学制药企业以及全球药企代表,就最新的化学药品注册法规变化、仿制药一致性评价、新靶点发现、化合物开发与筛选策略,剂型创新与给药途径改良,以及临床前、临床模型设立等系列等热点话题进行剖析,并提供了高实践性的解决方法和思路,精彩切实的干货,使200余位与会人员获益匪浅,满载而归。展商与参会者、演讲嘉宾的沟通也在茶歇、会场、鸡尾酒会上进行了有量有质的交流。作为国内化学制药领域最前沿的年度会议之一,第二届化学药论坛获得了与会人员的高度认可。
 中国化学制药工业协会
中国化学制药工业协会
中国化学制药工业协会(以下简称“协会”)成立于1988年9月,主要由从事(化学)药品生产的多种经济类型的骨干企业(集团)、地区性医药行业协会、医药研究及设计单位和大中专院校等组成。是民政部核准登记的全国性社会团体法人,其业务主管单位是国务院国有资产监督管理委员会。
 BMAP
BMAP
在当今快速变化的商业环境下,BMAP主要致力于为生命科学行业领先的专业人士提供无与伦比的专业知识,最新的资讯和世界级的专业服务来促进业务的增长。 在BMAP举办的活动中,我们通过广泛的专业调研,以创新的形式,聚集生命科学行业的领先实践者和专家学者,探讨最前沿的信息知识,以帮助行业专业人士应对当今不断升级的挑战。作为领先的信息服务提供商,BMAP提供丰富的内容来帮助业内企业提高质量标准,保证安全,不断创新和降低风险,以适应日益规范的市场环境。
随着国家仿制药一致性评价工作紧锣密鼓的推行,化学仿制药面临着日益严峻的对照与等效试验。与此同时,企业针对于改良新药、首仿药、超级仿制药、me-better、me-best药物等一系列仿创新药也在寻求差异化与最优化的战略突围。
在仿制药政策趋紧与创新药政策利好的风向下,PharmaCon 2017 第三届中国国际化学药仿创开发论坛于2017年10月19-20日于上海再度起航,将汇聚30多位行业内研发部门负责人、法规及技术专家,共同探讨新形势下仿制药申报与开发战略、仿制药一致性评价案例、溶出试验与体内体外相关性、生物等效性试验、仿创新药国内外立项机遇以及给药途径及制剂创新等六大专题话题,旨在通过仿创结合,加快药物创新步伐,提高药物创新效率,使企业从激烈的市场竞争中脱颖而出,从而立足于世界,走向国际化。

“十三五”医药行业在生产需求变化调整,企业需进一步保证整个生产工艺流程和质量体系的可控。基于药品生产及质量管理方面存在挑战,化学药生产与质量管理论坛将汇聚行业内质量和生产部门负责人就大家最为关注的上市许可人制度、计算化系统验证、数据可靠性、GMP科学监管、绿色环保、清洁验证及无菌生产等热点话题进行探讨,从而提高企业的生产与质量管理效率以及药品质量。


.jpg!hdj123)
赵大川
美国普霖斯通制药公司
执行总监
.jpg!hdj123)
钱忠直
国家药典委员会
首席专家
.jpg!hdj123)
刘学军
上海复星医药
研究院副院长
.jpg!hdj123)
陆明秋
罗氏研发(中国)有限公司
制剂部主任
.jpg!hdj123)
杜冠华
中国医学科学院
副院长
.jpg!hdj123)
赵栋
四川科伦药业股份有限公司
研究院副院长
.jpg!hdj123)
张志勇
广东乳源东阳光药业有限公司
总经理
.jpg!hdj123)
沈灵佳
江苏恒瑞医药
副总经理
.jpg!hdj123)
Tony Tong
梯瓦制药
副总裁
.jpg!hdj123)
Stefan Horkovics-Kovats
山德士(奥地利)
BE专家
.jpg!hdj123)
K.V.Surendranath
USP
中华区运营代理负责人
.jpg!hdj123)
Brian Berry
联亚实验室有限公司
科学与法务高级总监
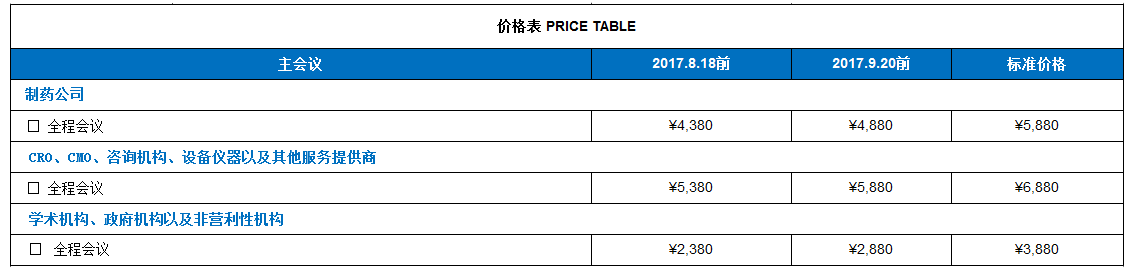
以上的优惠价格体系在截止日期内有效。所有的费用都需要在规定的有效日期内付款,否则将自动跳到下一个价格水平层。
学术机构、政府机构以及非营利性机构人员的价格:若申请此价格,贵单位必须提供资质证明。BMAP对此价格保留审合的权利。
付款原则
* 所有的付款必须在会议开展前完成。您所缴纳的费用包括大会的入场券、茶歇、午餐、会议手册以及根据政府规定的相应税金。
* 请注意住宿以及交通费用不包括在上述价格内。
价格与折扣原则
* 为了保障您的优惠价格席位,请您在优惠截止日期前提交注册表格并完成付款。
* 如果同一组织机构有3位或3位以上的工作人员参加可享受当期价格9折优惠,请注意团队优惠价格只提供给3人以上团队同时注册并由同一组织机构付款。
取消与替代原则
* 一旦确认注册成功就不能取消,但是如果您无法参加,欢迎推荐替代参会者。请在第一时间将代替您参会人员的详细信息提交给客服人员。
* 不管BMAP以任何理由取消此次活动,您所交付的款项将全额退还。
* 不管BMAP因为何种客观原因将活动延迟而致使参会人员无法如期参加的话,参会人员都将得到有BMAP提供的全额保值单据。您可以使用此单据参加任何一年内同等价值的活动。
* 除了以上的情况,任何其他形式的取消都将不会提供保值单据。
* 对于任何活动的改期、延迟和取消,BMAP无法对因为替代参会人员而产生的损失负责。如因不可抗拒的自然灾害、不可预见的突发事件或者任何其它客观原因导致此次活动无法进行,BMAP对此不负任何法律责任。此条款中陈述的不可预见的突发事件包括但不仅仅限于:战争、火灾、罢工、极端天气或其他类似情况。
相关会议
2026-03-28上海
2026-05-21上海