| 会议详情 |
|

推荐会议:2026年第十届眼科学教育大会
发票类型:增值税普通发票 增值税专用发票
CTD(Common Technical Document)申报资料格式是ICH 制定的关于药品申报注册文件的统一格式,已在世界各国达成一致成为了当今国际制药工业的主流规范。近年来,全球药监机构对于药品注册申请文件的质量要求不断提高。随着中国监管部门加入ICH并接受通用技术文档(CTD)格式递交,政策法规日趋国际化,这给药品研发从业人员也带来了更多机遇和挑战。
2017年5月5日开始,向美国FDA提交的文件就必须用电子通用技术文件格式(electronic Common Technical Document, eCTD)。没有例外,没有延迟。
CDE于2017年5月30日,同时发布了《药品电子通用技术文档结构(征求意见稿)》和《化学仿制药电子通用技术文档申报指导原则(征求意见稿)》。2019年3月1日又发布了《eCTD技术规范(征求意见稿)》和《eCTD验证标准(征求意见稿)》,这将加速我国ICH标准平台的建立,使中外药企在境内境外公平竞争,这将影响我国企业家海内外布局,并对我国药企在国内国际市场的地位产生长远影响。
如何深入理解CTD标准要求,通过多部门紧密合作高效优质地完成药品注册申报,缩小国内药品注册与国际注册的差距,提高注册效率与成功率,获得国内和欧美市场销售的合法资格,成为了药品注册人员发的新的挑战。为了帮助制药企业提高药品研发注册水平,学习和掌握 CTD 申报资料格式和各国资料差异,全面提升药品研发与注册专员的工作能力和职业素养,由北京医恒健康科技有限公司主办“2019 CTD申报资料撰写及准备专题培训班”,将于2019年9月26-28在北京召开。本次培训邀请业内权威专家针对相关问题进行深入解析。
课程
亮点
你将获得:
ICH-GTD概览
本模块将介绍ICH-CTD在欧美国家的应用与发展以及我国引入ICH-GTD的背景和目的、ICH-GTC的基本架构、在药企文件系统中的地位以及特点,并重点解读ICH 的M4,M4Q,M4S和M4E并介绍与药物研发的关联。
ICH-GTD的应用原则及案例分析
本模块将介绍ICH-GTD的基本规则以及我国CTD 格式各模块的撰写要点及案例分享,并比对FDA、EU的CTD大纲及申报必备文件,让大家掌握CTD的申报精髓。
国际DMF注册制度介绍
本模块将介绍DMF的性质及要求以及与CTD的关系,并着重讲解中国DMF及原辅包企业关联审评、美国FDA欧盟DMF法规介绍与分析,以及CEP认证的流程要求讲解。
我国实施eCTD的方向与政策落地
本模块将从审评员的角度介绍eCTD的含义及与CTD的关系,并分享全球eCTD实施现状、未来趋势及最新技术对我国的影响,本课程还讲解读《eCTD技术规范》和《eCTD验证标准》征求意见稿,并展望实施eCTD申报对我国药品发展及国际化道路的重大意义。
企业如何做好eCTD的准备
本模块将向大家介绍eCTD的文档、软件构建的关键要求,如何通过学习eCTD国外的发展及应用,借鉴经验,了解常见的eCTD系统供应商及选择标准,打造eCTD工作团队,案例剖析eCTD编写过程中常见的问题及解决方案。
CTD /eCTD在药品注册申报中的应用
本模块将分两个部分讲解,一为CTD 格式准备、申报流程与递交管理以及递交后与监管机构的沟通及常见问题解析;一为借鉴国外eCTD注册申报立卷审查要点解析,学习eCTD如何顺利通过申报。
PART 1/目标学员
如果你是:
药品研发人员;
注册申报人员;
质量控制人员;
项目负责人及有关研究单位人员。
PART 2/授课模式
知识讲解、案例经验讲解、课题讨论答疑
北京豪创未来科技有限公司于2019年9月26日举办2019 CTD申报资料撰写及准备专题培训班。
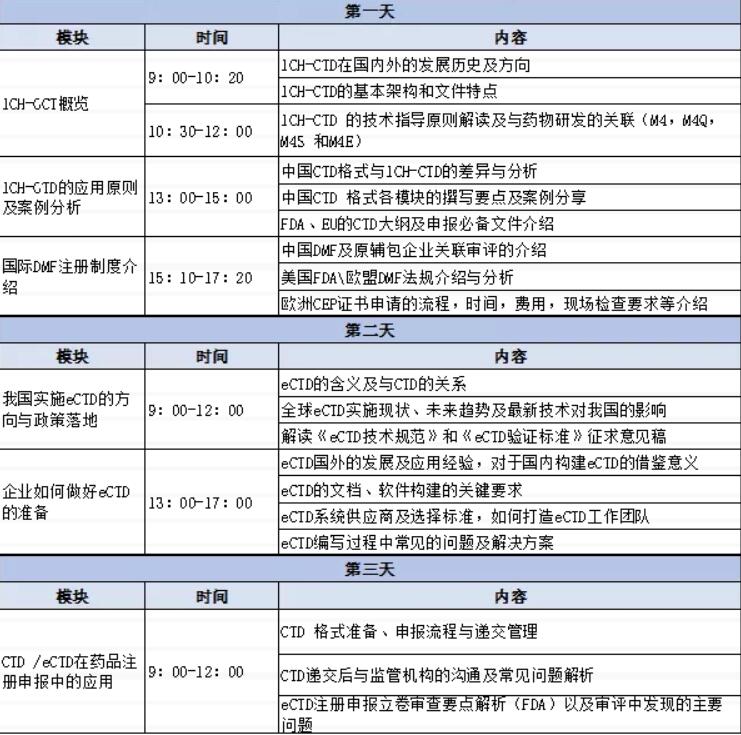
模块
1CH-CCT相概览
1CH-CGTD的应用原则及案例分析
国际DWF注册制度介绍
我国实施eCTD的方向与政策落地
企业如何做好eCTD的准备
CTD/eCTD在药品注册申报中的应用
内容:
1CH-CTD在国内外的发展历史及方向
1CH-CTD的基本架构和文件特点
1CH-CTD的技术指导原则解读及与药物研发的关联(M4,M4Q,
45和4E)
中国CTD格式与1C-CID的差异与分析
中国CTD格式各模块的撰写要点及案例分享
FDA、EU的CTD大纲及申报必备文件介绍
中国DF及原辅包企业关联审评的介绍
美国FDA\\欧盟MF法规介绍与分析
欧洲CEP证书申请的流程,时间,费用,现场检查要求等介绍
eCTD的含义及与CTD的关系
全球eCTD实施现状、未来趋势及最新技术对我国的影响
解读《eCTD技术规范》和《eCTD验证标准》征求意见稿
eCTD国外的发展及应用经验,对于国内构建eCTD的借鉴意义
eCID的文档、软件构建的关键要求
eCID系统供应商及选择标准,如何打造eCID工作团队
eCTD编写过程中常见的问题及解决方案
CTD 格式准备、申报流程与递交管理
CID递交后与监管机构的沟通及常见问题解析
eCTD注册甲报立卷审查要点解析(FDA)以及审评中发现的主要
问题
课程讲师
讲者更新中......
李友翾 博士
FDA原审评官、TWG高级顾问
李博士在The WhiteOak Group (TWG)中从事法规咨询的工作,领导和参与了近20项美国FDA申报注册及研发项目,涵盖了新药临床、仿制药、原料药和相关的cGMP审计等方面。在加入TWG前,李博士在美国食药监局(FDA)下属的新药质量评价办公室(ONDQA)里从事与抗肿瘤药物CMC审评相关的工作。李友翾博士在美国南卡莱罗纳医科大学获得药学博士学位,是美国科学研究协会(Sigma Xi Society),国际药学荣誉协会(Rho Chi Society)等协会会员。
Jimmy Chen
美国DoubleBridge 副总裁、eCTD专家
2003年至今专注eCTD技术标准研习和eCTD相关软件产品设计,精通各国各版本eCTD技术标准。为辉瑞,GSK,赛诺菲等大型医药外企服务十余年。多次在国际药品相关协会演讲 eCTD 和文件储存管理系统相关议题。
培训费用:3600元/人;
早鸟价:3200元/人,(2019年8月30日前报名,并缴费成功);
团购价:3200元/人,(3人以上,报名)
相关会议
2026-03-20汕头
2026-04-09上海